Wstęp
Do zeszłego roku uważano, że chorobę świń przebiegającą z powstawaniem pęcherzyków (vesicular disease – VD) może wywoływać jeden z 4 wirusów RNA: wirus pryszczycy (FMDV, aftowirus z rodziny Picornaviridae), wirus pęcherzykowego zapalenia jamy ustnej (VSIV, lub VSV, wesikulowirus z rodziny Rhabdoviridae), wirus usutki pęcherzykowej świń (VESV, weziwirus z rodziny Calciviridae) lub wirus choroby pęcherzykowej świń (SVD, enteriwirus z rodziny Picornaviridae). Na potrzeby tego artykuły będę określał te wirusy jako Wielka Czwórka.

Sporadycznie stwierdzano u świń na świecie (Nowa Zelandia, Włochy, USA, Brazylia) przypadki VD gdzie nie stwierdzono żadnego wirusa z grupy Wielkiej Czwórki. W niektórych przypadkach w populacja świń dotkniętych VD, ujemnych w kierunku wirusów z Wielkiej Czwórki, wykryto senekawirusa A (SVA). Takie przypadki choroby nazwano idiopatyczną chorobą pęcherzykową świń, ponieważ związek SVA a VD był niejasny.
Wirus SVA posiada genom zbudowany z RNA i należy do rodziny Picornaviridae (razem z FMDV i SVDV). Uprzednio nazywano go wirusem Doliny Seneca. W literaturze dotyczącej zdrowia człowieka SVA jest znany jako wirus onkolityczny. Obecnie prowadzone są badania kliniczne nad wykorzystaniem SVA w terapii raka u ludzi. Wiadomo, że SVA może ulegać replikacji u świń, bydła i gryzoni. Ostatnio opisano dwie choroby u świń związane z SVA: epidemiczny, przejściowy zespół śmiertelności noworodków (ETNL) i chorobę pęcherzykową.
Przedmiotem tego artykułu jest opis klinicznego przypadku VD związanego z identyfikacją SVA.
Przypadek
Ferma:
Ferma o cyklu zamkniętym o stadzie podstawowym liczącym 8000 loch była zlokalizowana na południowym wschodzie Brazylii i składała się z wielu naturalnie wentylowanych budynków. Loszki remontowe produkowano na fermie. Nasienie pochodziło od zewnętrznego producenta i było dostarczane 3 razy w tygodniu (poniedziałek, środę i piątek). Personel był zatrudniony wyłącznie w tej fermie a sprzęt nie był wypożyczany do lub z innych obiektów. Poziom bioasekuracji był bardzo wysoki (pomieszczenie dekontaminacji, prysznice na wejściu i wyjściu, niska częstotliwość transportów świń, mycie i dezynfekcja naczep, 24-godzinna przerwa przed załadunkiem, region i niskim pogłowiu świń). Na fermie nie stwierdzono VD w całej 10-letniej historii. Ferma była PRRSV-ujemna i Mycoplasma hyopneumoniae-dodatnia. Kojce warchlaków mieściły po 60 sztuk a dla tuczników po 30 sztuk.
Pojawienie się objawów choroby:
Dzień 1-3: personel fermy zaobserwował, że tuczniki były mniej aktywne niż zwykle lecz nie zawiadomiono o tym lekarza weterynarii. Nie zaobserwowano żadnych zmian patologicznych ani kulawizny.
Dni 4-10: u około 25% tuczników i 15% warchlaków zaobserwowano kulawiznę. Lekarza poinformowano w dniu 9 i wizyta na fermie miała miejsce w dniu 10. Podejrzewano zakażenie Mycoplasma hyosynoviae. W czasie wizyty na fermie obserwacji poddano wszystkie grupy wiekowe świń. Lekarz stwierdził niewielkie zmiany w obrębie wału koronowego i przestrzeni międzypalcowej u większości (>90%) kulejących tuczników i niektórych warchlaków (~30%).
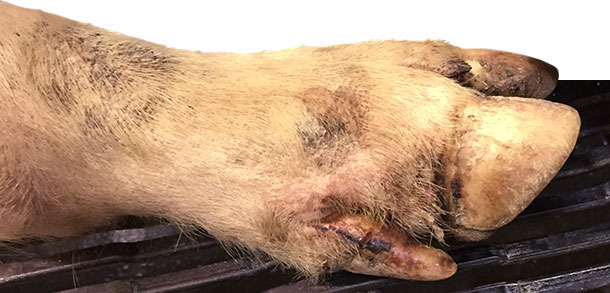
Stwierdzono również pęcherze o średnicy 0,5-1,5 cm na ryju u około 1% świń (jedna świnia na 3 kojce). Pęcherze na ryju stwierdzono jedynie u dwóch warchlaków.
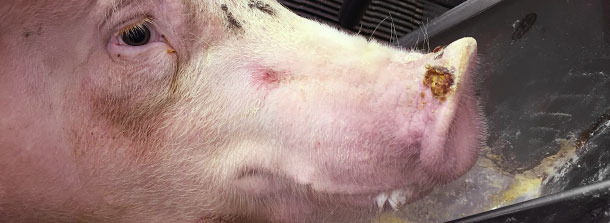
Lekarz powiadomił służby weterynaryjne i rozpoczęto procedurę badania w kierunku chorób egzotycznych. Płyn z pęcherzy i wymazy z wału koronowego wybranych sztuk przesłano do laboratorium referencyjnego. Badania w kierunku wirusów z Wielkiej Czwórki dały wyniki ujemne. Wyniki otrzymano po 3 dniach. Wszystkie próbki reagowały dodatnio teście RT-PCR dla SVA. Jesienią 2014 roku testy serologiczne do badania serokonwersji SVA nie były dostępne.
W kolejnych dniach kontynuowano obserwacje w kierunku VD. U loch nie stwierdzono kulawizny ani zmian pęcherzykowych. Przez około 7 dni obserwowano przejściowy wzrost śmiertelności noworodków aż do 50%. Nie stwierdzono zmian pęcherzykowych u prosiąt ani ich matek.
U warchlaków i tuczników stale pojawiały się nowe przypadki kulawizny niewielkie zmiany pęcherzykowe. Przez około 4 miesiące od pojawienia się problemu objawy obserwowano u około 5% świń tygodniowo.
Świnie, u których pojawiała się kulawizna znakowano i codziennie monitorowano klinicznie. Zmiany pęcherzykowe obserwowano u większości kulejących zwierząt, w dniu 0 i 1-2 dni później. Zmiany pęcherzykowe goiły się w ciągu 7-10 dni. Nie stwierdzono zwiększonej śmiertelności.
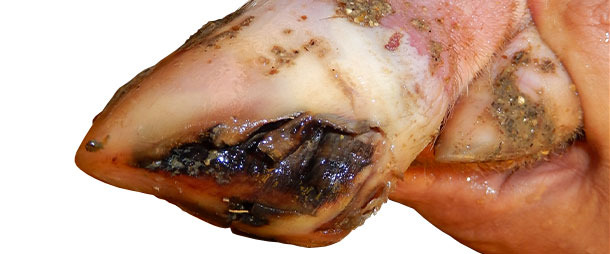
Między 4 i 5 miesiącem od pojawienia się problemu występowanie VD niemal zanikło. Obecnie na fermie od 6 miesięcy nie stwierdza się VD ani zwiększenia liczby kulawizn. Leczenie chorych świń było zależne od nasilenia objawów. U świń z silnymi zmianami na kończynach stosowano podstawową dezynfekcję. U pojedynczych sztuk stosowano antybiotyki w iniekcji oraz leki przeciwzapalne w celu zapobiegania infekcji bakteryjnych.
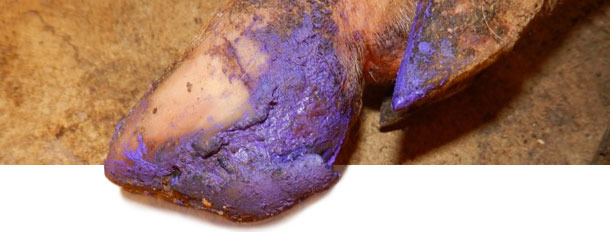
Końcowe wnioski
Ostatnie badania Uniwersytetu Stanowego Iowa (ISU) i Departamentu Rolnictwa USA (USDA) zaprezentowane na konferencji w Ames, Iowa, USA, dowiodły możliwości wywołania VD przy po zakażeniu świń izolatami SVA od chorych świń. Dlatego też SVA należy obecnie uważać za kolejny patogen obok Wielkiej Czwórki wywołujący chorobę pęcherzykową świń (obecnie Wielka Piątka).
Chociaż VD wywołana przez SVA przebiega znacznie łagodniej niż pryszczyca, początkowe zmiany obserwowane u świń są nieodróżnialne od zmian wywołanych wirusem pryszczycy. Wykluczenie FMDV musi być każdorazowo przeprowadzone przez służby weterynaryjne i absolutnie w przypadku obserwacji zmian pęcherzykowych nie wolno zakładać, że jest to kolejny przypadek zakażenia SVA, nawet jeśli w okolicznych fermach wirus ten jest przyczyną choroby.
W opisanym przypadku nie wykryto źródła wirusa. Wiadomo, że choroba wystąpiła na przynajmniej 8 fermach położonych w promieniu 10 km od opisanej fermy. Przypuszcza się, że do transmisji mogło dojść za pośrednictwem komarów (inne pikornawirusy mogą być przenoszone w ten sposób), aerozoli, składników paszy, szczepionek i środków transportu.
Opisany przypadek jest dobrym przykładem, że do pojawienia się patogenu może dojść w każdym czasie. Elementy bioasekuracji fermy powinny być pod stałym nadzorem.







