Histologiczna ocena fragmentów jelit wymienionych w poprzednim artykule umożliwia wskazanie patogenu zaangażowanego w proces chorobowy, a w niektórych przypadkach określa obecność czynników zakaźnych. Na przykład atrofia kosmków może być spowodowana przez I. suis (kokcydia), rotawirusy, TGEV, PEDV, deltakoronawirusy, czy też C. perfringens typu A. W przypadku I. suis, jeżeli próbki pochodzą od prosiąt starszych niż pięć, sześć dni, to w cytoplazmie można znaleźć zarówno formy rozmnażające się płciowo, jak i bezpłciowo I. suis znajduje się w cytoplazmie enterocytów na końcach kosmków. Jeśli kokcydia nie zostanią znalezione, można wykonać diagnostykę immunohistochemiczną na obecność antygenu rotawirusa lub koronawirusa. W niemal wszystkich przypadkach ETEC badanie histologiczne ujawnia obecność ogromnej ilości kokopałeczek przyklejonych do enterocytów u podstawy lub części bocznej kosmków. C. perfringens typu C powoduje martwicę kosmków i zmiany krwotoczne fragmentów jelita cienkiego. C. difficile jest jedynym czynnikiem zakaźnym powodującym zmiany w jelicie grubym. Często obserwowuje się obrzęk krezki okrężnicy. Histologicznie można zaobserwowaćt spadek liczby komórek kubkowych i intensywny naciek neutrofili w błonie śluzowej okrężnicy, co czasami może powodować rozerwanie nabłonka. Przypomina to nieco wybuch wulkanu. C. perfringens typu A jest najtrudniejsze do zdiagnozowania za pomocą histopatologii. Pategen ten może powodować zanik kosmków, ale nie znalezienie takich zmian w preparacie nie wyklucza zakażenia C. perfringens.
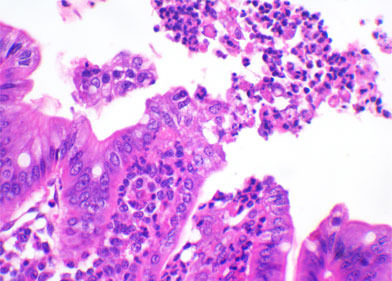
Clostridium difficile

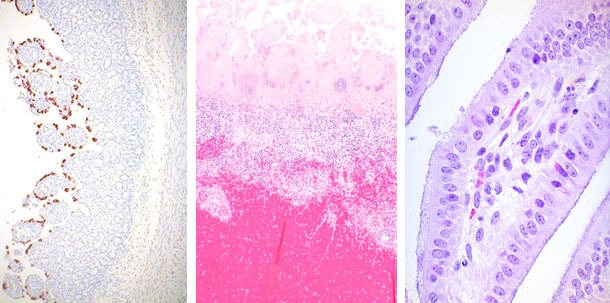
| Rotavirus | Clostridium perfringens | E. coli |
W przypadku bakteriologii świeżych próbek jelit ważne jest, aby być wykonać badanie zarówno w warunkach tlenowych jak i beztlenowych. E. coli łatwo namnaża się na agarze z krwią i podłożu. Jednak nawet czysty wzrost kolonii beta-hemolizujących nie daje nam ostatecznej diagnozy, ponieważ nadal konieczna jest diagnostyka genetyczna czynników chorobotwórcznych, takich jak fimbrie (F4, F5, F41, F18, ...) i toksyny (LT, STA, STB STx2e, ...). Takie typowanie jest najczęściej wykonywane za pomocą multiplex PCR. Hodowla w warunkach beztlenowych jest niezbędna do potwierdzenia obecności C. perfringens typu C, w połączeniu z typowaniem (multiplex PCR) genów toksyn, np. beta- toksyny. C. perfringens typu A i C są nie do rozróżnienia standardowymi metodami bakteriologicznymi. W przeszłości wykrycie genu beta-2 toksyny było markerem chorobotwórczych szczepów C. perfringens typu A, ale ostatnie badania przeprowadzone przez naszą grupę i grupę z Iowa State University wykazały, że beta2- toksyczne szczepy C. perfringens typu A są częściej znajdywane u zdrowych prosiąt niż u biegunkujacych. W rezultacie ostatecznai diagnoza C. perfringens typu A stanowi największe wyzwanie.
Izolacja wirusa nie jest łatwym zadaniem w ramach rutynowej diagnostyki. W związku z tym stosuje się metody alternatywne. W niektórych laboratoriach USA w celu wykrywania cząstek korona lub rotawirusa wykorzystuje się elektronowy mikroskop transmisyjny. Jednak częściej wykonywana jest elektroforeza w żelu poliakrylamidowym (PAGE) na próbkach kału, co pozwala na identyfikację segmentowanego RNA rotawirusa A, B i C. Znacznie czulszy jest multiplex PCR. Multiplex PCR, zawierający różne zestawy starterów, jest często stosowany w diagnostyce koronawirusa w Ameryce Północnej (PED TGE i deltakoronawirusa).
Kał z jelita grubego stanowi dobry materiał do wykrywania toksyn A i B C. difficile. Mimo, że ta bakteria jest częścią normalnej mikroflory jelitowej, to wykrycie wyżej wspomnianych toksyn za pomocą zestawów ELISA jest istotne w rozpoznaniu choroby. Komercyjne zestawy ELISA zostały opracowane i zoptymalizowane na próbkach ludzkich, więc ich czułość w przypadku prosiąt jest niska. W związku z tym zalecia się aby pobrać minimum 3- 6 próbek kału od biegunkujących prosiąt. Oparty na tej samej zasadzie badanie kału jest często stosowane w celu wykrycia oocytów kokcydii; jednak czułość jest również niska, więc zaleca się pobranie kału trzech do pięciu prosiąt z miotu, gdzie obserwuje się biegunkę, w sumie do 10% miotów w wieku od 7 do 21 dni .
Podsumowując, wykrywanie czynników enteropatogennych u nowonarodzonych prosiąt jest zawsze wyzwaniem. Głównym aspektem diagnostyki, który nie może być pominięty, jest branie pod uwagę wszystkich istniejących możliwości. Próbki muszą być pobierane i badane na wszystkie możliwe czynniki, które mogą powodować biegunkę. PCR jest potężnym narzędziem, ale można na nim ślepo polegać. Starsze techniki, takie jak histopatologia pomogą w interpretacji wyników i poszerzą waszą perspektywę.


